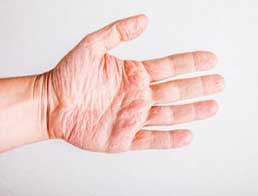
Атопічний дерматит (АД) — хронічне захворювання шкіри, одне з тріади алергічних хвороб, дебют якого припадає на період раннього дитинства. Однак, згідно зі статистичними даними, до 10% пацієнтів хворіють на АД у дорослому віці (Silverberg J.I., Hanifin J.M., 2013). Особливостями клінічної характеристики дорослих з АД є тривалий перебіг та численні загострення, під час яких виникає свербіння шкіри різного ступеня вираженості, найбільше — у нічний час на бокових поверхнях тіла, згинах ліктів та колін, обличчі, повіках. У сучасних поглядах на механізм формування порушення велику увагу приділяють виникненню неспецифічного запалення. Вважається, що пов’язані між собою стимулювальні фактори та чинники АД призводять до активації імунокомпетентних клітин та підвищення продукування прозапальних цитокінів, зокрема інтерлейкінів-2 та -4. У результаті фенотип антигенпрезентуючих клітин перетворюється на запальний фенотип і формуються алергенспецифічні Т- та В-лімфоцити, які вражають органи-мішені, зокрема шкіру. Незважаючи на наявні можливості медикаментозного лікування, у частини дорослих пацієнтів з АД тривало зберігаються залишкові клінічні симптоми, що значно погіршує якість життя та призводить до негативних соціальних наслідків. Попередні дослідження свідчили про задовільну клінічну відповідь на застосування рекомбінантного антитіла IgG дупілумабу (Hendricks A.J. et al., 2019). Однак ін’єкційна форма випуску препарату та серйозні побічні ефекти від тривалого застосування спричинили подальший пошук ефективного таргетного лікарського засобу, один з яких — низькомолекулярний біосиміляр аброцитиніб, механізм дії якого полягає у блокуванні ферменту янус кінази-1 та послідовному зменшенні продукування інтерлейкцну-4. Група дослідників відділення дерматології Вашингтонського університету на чолі з Джонатаном Сільвербергом (Silverberg J. et al., 2020) дослідили дозозалежний лікувальний ефект та безпеку аброцитинібу (NCT03575871). Результати опубліковані у журналі JAMA Dermatology («Дерматологія» Американської медичної асоціації). До дослідження залучено 391 пацієнт віком ˃ 12 років з помірним або тяжким субклінічним перебігом дерматиту на тлі застосування стандартизованого лікування ˂4 тиж за останні 6 міс. Дві інтервенційні групи отримували аброцитиніб у дозі 100 та 200 мг (155 та 158 пацієнтів). Третя група була контрольною (78 пацієнтів). За результатами опитування за шкалою загальної оцінки дослідника (EASI-75) визначали мінімальний індекс площі пошкодження шкіри і тяжкості екземи на 12-й тиждень (≥75% точок шкали). За вторинну точку дослідження було вибрано питому частку пацієнтів, які досягли покращення ≥4 точок за чисельною рейтинговою шкалою максимального свербіння (PP-NRS). Додатково досліджували безпеку препарату та лабораторні показники. Таким чином, необхідні подальші дослідження з метою пошуку шляхів стандартизації застосування низькомолекулярних біосимілярів у пацієнтів з атопічним дерматитом. Жарікова Юлія Джерело: https://www.umj.com.ua/
Результати
Висновки
0