Комітет радників Управління з контролю за продуктами й ліками США (FDA) днями одноголосно проголосував, що вакцина Pfizer, яка вводиться у вигляді ін’єкцій під час вагітності, є ефективною для захисту немовлят від важкої респіраторно-синцитіальної вірусної (РСВ) хвороби протягом перших 6 місяців життя.
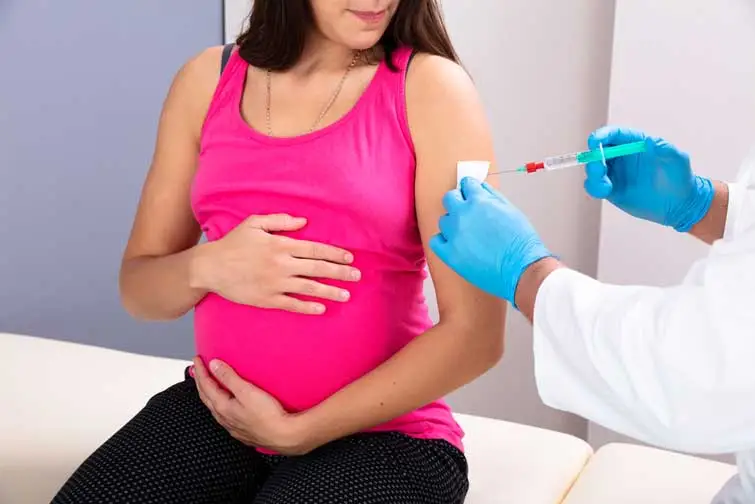
Якщо агентство схвалить, вакцина стане серйозним прогресом проти захворювання, яке є основною причиною госпіталізації немовлят у США. Але фахівці стурбовані даними про побічні ефекти, зареєстровані підчас випробувань Pfizer і відмовою іншого великого виробника ліків від подібної вакцини під час вагітності. Думки комісії розділилися щодо питання про безпеку вакцини, і багато членів були стурбовані тим, що вона може збільшити рівень передчасних пологів.
Минулого року компанія GlaxoSmithKline (GSK) припинила пізню стадію клінічних випробувань своєї вакцини проти RSV на вагітних через підвищений ризик передчасних пологів і пов’язану з цим неонатальну смерть у дітей, народжених передчасно. У дослідженні GSK ймовірність передчасних пологів була на 38% більшою у вагітних, які отримували щеплення, ніж у групі плацебо . І в даних Pfizer, представлених групі, також були натяки на надмірну кількість передчасних пологів. Консультанти FDA висловили розчарування тим, що остання фаза 3 випробування компанії була недостатньою, щоб дізнатися, чи було збільшення показника в групі вакцинованих порівняно з групою плацебо — 5,7% проти 4,7% — реальним ефектом, оскільки різниця не була статично незначною.
RSV є основною причиною інфекцій нижніх дихальних шляхів у немовлят у всьому світі, вбиваючи приблизно 13 000 немовлят віком до 7 місяців щороку в лікарнях по всьому світу. Це також завдає значних збитків у ранньому віці дітей дошкільного віку, вбиваючи приблизно 101 000 дітей до того, як вони досягнуть 5 років. У Сполучених Штатах щорічно госпіталізують від 2% до 3% немовлят, переважно у віці від 0 до 5 місяців. Сотні не виживають. Вірус також стимулює близько 500 000 відвідувань відділень невідкладної допомоги в США щорічно.
Але занепокоєння щодо передчасних пологів виникло під час зустрічі, оскільки діти, народжені раніше стандартних 37 тижнів вагітності, також мають значно вищий ризик смерті та інвалідності як від RSV, так і загалом, що може звести нанівець будь-які переваги вакцини.
Пізня стадія клінічного випробування Pfizer охопила понад 7300 вагітних у 18 країнах і задокументувала 201 передчасну смерть у групі вакцинованих проти 169 у групі плацебо.
Цих даних було достатньо, щоб змусити чотирьох із 14 експертів проголосувати проти питання про те, чи достатні дані, щоб сказати, що вакцина безпечна. Інші члени комітету заявили, що користь від вакцини переважає їхні побоювання щодо ризику.
Вакцина Pfizer містить виготовлені в лабораторії версії поверхневого білка RSV-F, який зливається з клітинами-господарями, дозволяючи вірусу проникати в них. Компанія розробила вакцину після фундаментальної роботи вчених Національного інституту охорони здоров’я США, які розробили метод блокування білка, що змінює форму, у його попередній конформації, що викликає потужну імунну відповідь. Велике клінічне випробування, результати якого були опубліковані в журналі The New England Journal of Medicine минулого місяця, випробувало вакцину на 3682 жінках між 24 і 36 тижнями вагітності. Ще 3676 осіб на тих же термінах вагітності отримували плацебо. Вакцина призначена для вироблення F-блокуючих антитіл у дорослих, які передадуть їх через плаценту плоду на пізніх стадіях вагітності. Отримані таким чином захисні материнські антитіла зберігаються у дитини протягом перших місяців життя до того, як її імунна система досягне достатньої зрілості для вироблення власних захисних антитіл.
Ефективність вакцини склала 69,4% щодо захисту немовлят віком до 6 місяців від важких інфекцій нижніх дихальних шляхів. Для немовлят віком до 3 місяців, у яких рівень інфікування найвищий, ефективність становила 81,8%. Вакцина також була ефективна на 51,3% запобіганні менш важким інфекціям, які все ще вимагали медичної допомоги. Проте, дискусія наразі йде про можливе постмаркетингове дослідження безпеки в разі попереднього схвалення. Саме такий потенційний підхід і викликав суперечки серед експертів.
Наразі лікування RSV-інфекції є лише підтримуючим, за винятком немовлят із групи високого ризику, які мають право на щомісячні ін’єкції моноклонального антитіла палівізумабу. Інше таке антитіло, нірсівемаб, може бути схвалено FDA пізніше цього року. Це одноразова ін’єкція тривалої дії, яку AstraZeneca шукає дозволу на використання для всіх немовлят.
Єдина затверджена на сьогодні вакцина проти RSV орієнтована на пацієнтів старших за 60 років.
За матеріалами: Science NEWS
0

