Управління з контролю за якістю харчових продуктів і медикаментів США (FDA) планує незабаром схвалити новий препарат для лікування рідкісної форми бічного аміотрофічного склерозу (БАС).
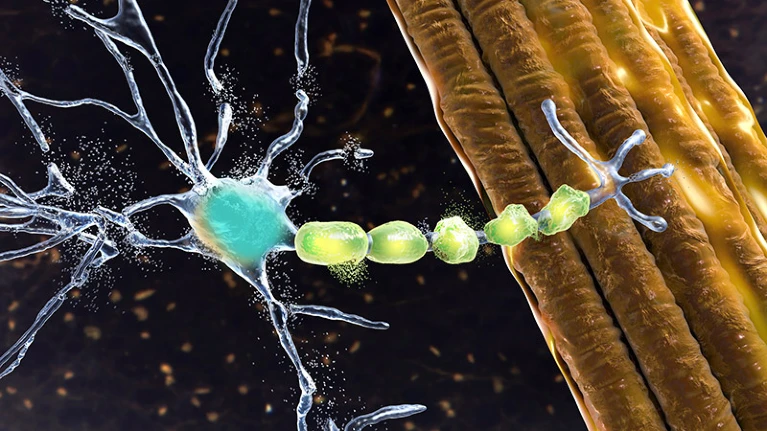
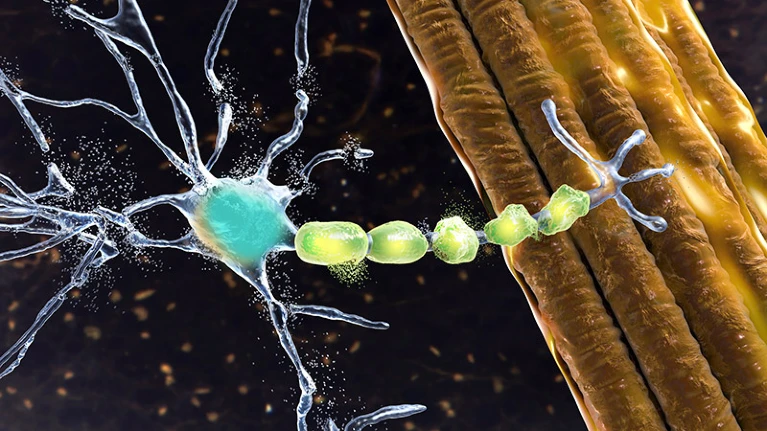
У людей з бічним аміотрофічним склерозом (БАС) рухові нейрони, які допомагають надсилати команди від мозку до м’язових клітин, пошкоджуються, як зображено на цьому рендері художника. Автор: Катерина Кон
Пацієнти з цим захворюванням відчайдушно потребують нових методів лікування, оскільки вони стикаються з дегенеративним станом, який спричиняє загибель нейронів і зазвичай призводить до летальної дихальної недостатності протягом трьох років після появи симптомів. Препарат тоферсен за результатами 3 фази клінічних досліджень не сповільнив прогресування захворювання у пацієнтів. Однак, науковці запевняють, що були виявлені певні ознаки користі – такі як зниження біомаркера пошкодження і смерті нейронів (NFL, або легкий ланцюг нейрофіламенту).
Тож, компанія-виробник звернулась до контролюючих органів (FDA), посилаючись на отримані дані та з наголосом, що дослідження було занадто коротким, з проханням схвалити препарат за «прискореною» процедурою, щоб забезпечити доступ пацієнтів до лікування, і в майбутніх дослідженнях з’ясувати, чи препарат діє. У разі схвалення, тоферсен стане останнім прикладом еволюції підходу агентства до розробки неврологічних препаратів, що може збільшити інвестиції галузі в захворювання мозку.
Останнє обговорення радниками FDA вказало на «достатньо вірогідну» ймовірність того, що препарат допоможе людям з SOD1-БАС. Це рідкісне захворювання, спричинене мутаціями, які впливають на білок SOD1, це призводить до утворення токсичних накопичень у нейронах кори та стовбура головного мозку і спинного мозку. Тоферсен зв’язується з мРНК SOD1 і уповільнює вироблення білка. Знижуючи накопичення нейротоксину, тоферсен спрямований на збереження рухових нейронів і допомагає людям жити сильніше та довше.
Компанія-виробник протестувала препарат в рамках 3 фази клінічних досліджень, в яких взяли участь 108 пацієнтів. Через 6 місяців отримувачі тоферсену показали себе не краще, ніж отримувачі плацебо. Проте, рівень біомаркера NFL знизився в основній групі пацієнтів, порівняно з плацебо. Крім того, результати відкритого продовження випробування, в якому всім учасникам пропонували тоферсен, показали, що шість місяців, можливо, було занадто коротким періодом, щоб побачити ефект.
З іншого боку, обговорення Тоферсена також підкреслюють зростання NFL як інструменту розробки ліків. NFL - це паличкоподібний білок, який функціонує як внутрішній каркас для нейронів. Коли нейрони пошкоджуються або гинуть, вони викидають NFL у спинномозкову рідину та кров. Нейробіологи давно припускали, що рівні NFL можна використовувати для вимірювання здоров’я мозку. Після того, як приблизно десять років тому дослідники знайшли спосіб точного вимірювання рівня NFL у крові, використання маркера набуло популярності в дослідницьких лабораторіях і в клінічних випробуваннях.
Чому ж можуть розпочатись гарячі суперечки? У 2021 ро FDA схвалила адуканумаб, від того ж виробника, для лікування хвороби Альцгеймера — незважаючи на непереконливі докази ефективності та всупереч рекомендаціям консультативної групи. Це прискорене схвалення розділило спільноту фахівців, а розслідування Конгресу США згодом виявило, що воно «було повне порушень» . Критики поставили під сумнів не тільки достовірність даних про адуканумаб, але й те, що компанія виробник вибрала справедливу ціну на препарат.
Різниця все ж між такими схваленнями суттєва - у США хвороба Альцгеймера вражає понад 6 мільйонів людей, коли лише 330 мають SOD1-БАС.
Експерти кажуть, що кампанія виробник розробила власне дослідження, яке було занадто коротким, і в разі схвалення тоферсену регулятори, лікарі та пацієнти мають максимально використати набір непереконливих даних. До того ж інші виробники також можуть вимагати подібної процедури.
За матеріалами: NATURE.COM
0