Зараз триває масштабне ключове дослідження леканемабу, проривного препарату від хвороби Альцгеймера. Це третя фаза загальноприйнятого порядку клінічних випробувань, вона відрізняється більш широким дослідженням на широкій когорті пацієнтів. Леканемаб та інший нещодавно схвалений препарат під назвою адуканумаб належать до класу антитіл, які зв’язуються з бета-амілоїдом, білком, який, як вважається, сприяє прогресуванню хвороби Альцгеймера.
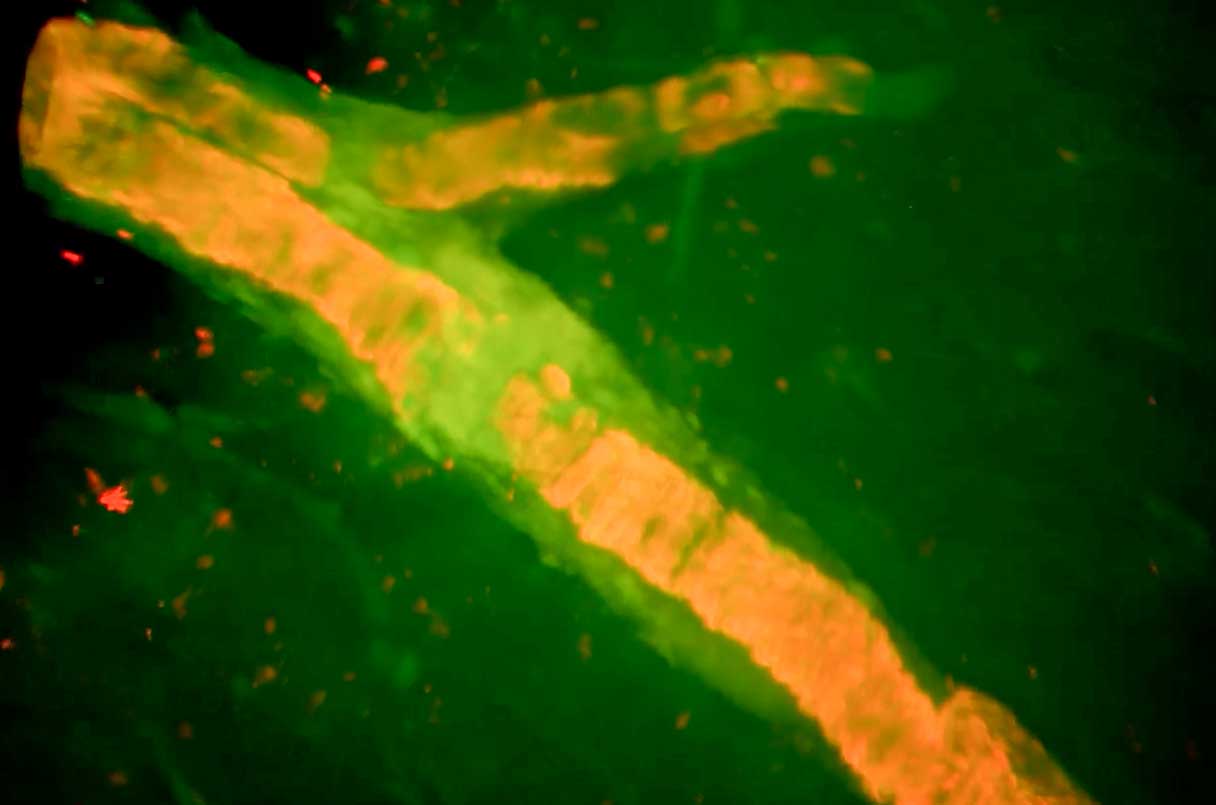
У головному мозку жінки, яка померла після прийому нового препарату від хвороби Альцгеймера, видно амілоїд (помаранчевий), що вистилає кровоносні судини, і місце, де судина розірвалася та кровоточила (жовто-зелене).
У січні FDA схвалила леканемаб для використання після того, як клінічні випробування показали, що він видаляє відкладення амілоїду в мозку, ефект, за словами агентства, «достатньо ймовірно передбачити клінічну користь». У 2021 році агентство покладалося на ті ж аргументи, схвалюючи адуканумаб.
Для свого «прискореного» схвалення леканемабу FDA не врахувало те, що багато хто вважав ключовим доказом 3-ї фази дослідження антитіл. Після 18 місяців використання леканемаб помірно уповільнив нищівне когнітивне погіршення хвороби Альцгеймера — перший препарат, який явно зробив це.
Повний розтин і детальне дослідження мозку 79-річної жінки з Флориди, яка померла після прийому леканемабу, посилили занепокоєння деяких дослідників щодо того, що це становить серйозний ризик для пацієнтів, які поділяють існуючий стан жінки, який важко діагностувати.
Історія пацієнтки та розтин «переконливо свідчать про те, що інфузії леканемабу були каталізатором, що призвело до подій, які призвели до її смерті
Автори стверджують, що смертельний набряк мозку жінки та крововилив, ймовірно, виникли в результаті того, що препарат, моноклональне антитіло, атакувало аномальні білкові відкладення, які накопичилися в її кровоносних судинах.
Доповідь про випадок і рекомендації експертів, ймовірно, стануть гарячими темами на засіданні консультативної групи FDA щодо препарату, яке агентство запланувало на 9 червня. Комісія оцінить плюси та мінуси препарату до того, як FDA прийме остаточне рішення про повне схвалення, ймовірно, у липні.
Початковий аналіз показав, що жінка зрештою померла від поліорганної недостатності та пневмонії через 5 днів після того, як у неї почалися судоми, набряк мозку та кровотеча. Жінка мала ранню хворобу Альцгеймера та помірну, безсимптомну ішемічну хворобу серця, але в іншому стан її здоров’я був хорошим, коли вона приєдналася до випробування. Як і всі пацієнти з хворобою Альцгеймера, жінка також ризикувала захворіти на церебральну амілоїдну ангіопатію (CAA). При хворобі Альцгеймера бета-амілоїд накопичується між клітинами головного мозку в характерних відкладеннях, які називаються бляшками. Але приблизно у половини пацієнтів білок також значною мірою замінює гладкі м’язи стінок кровоносних судин, роблячи їх крихкими. Такі антитіла, як леканемаб, часто видаляють цей амілоїд, роблячи судини слабкими, запаленими та схильними до небезпечної кровотечі. Інші люди, які померли під час випробування леканемабу, приймали засоби для розрідження крові , що, ймовірно, підвищувало їхній ризик. Але не ця пацієнтка.
Окрім ослаблення стінок кровоносних судин, леканемаб та інші антиамілоїдні антитіла можуть становити ще одну небезпеку для людей із CAA, кажуть дослідники. Коли антитіла видаляють згустки амілоїду з мозкової тканини, агломерації можуть закупорювати кровоносні судини та призводити до «запального каскаду», що підвищує ризик небезпечних для життя набряків і кровотеч.
За словами патологоанатома Північно-західного університету Рудольфа Кастеллані, звіт містить остаточні докази того, що леканемаб, який зараз продається як «Лекебмі», почав ланцюжок подій, які призвели до смерті жінки.
Лекембі є токсичним для церебральних судин у людей із ССА та потенційно смертельним
Наразі дослідники закликають, що леканемаб не має застосовуватись у пацієнтів, які приймають препарати для розрідження крові, а таких в когорті дослідів переважна більшість. Також, науковці закликають FDA переглянути критерії безпеки та призначення препарату.
За матеріалами: Science.org
0

